Атомарная точность молекулярной механики
органическая химия
Анализ ситуации в области селективного органического синтеза, проведенный российскими химиками, позволяет говорить о появлении нового направления в органической химии. Синтез как простых молекул, так и сложных биологически активных соединений все чаще идет с "атомарной точностью" (atomic precision).
В последние годы коллективом российских химиков был завершен ряд крупных проектов. Синтезировано более трехсот органических молекул с заданными свойствами. Среди них — структурные блоки лекарственных препаратов, биологически активные соединения, компоненты "умных" материалов нового поколения, функциональные производные для наноэлектроники.
Подобные работы активно ведутся во всем мире, конкуренция очень высока. Проведение химических реакций исключительно по заданному атому в молекуле — мечта любого химика-синтетика и "Священный Грааль" всей органической химии в целом. Вот почему было важно проанализировать ситуацию в современной методологии органического синтеза и определить перспективность конкретных направлений.
В рамках проекта реализована беспрецедентная по масштабам работа по анализу состояния тонкого органического синтеза. В ней участвовали более четырех десятков исследователей из ведущих химических лабораторий тринадцати научных центров от Новосибирска до Санкт-Петербурга.
Нельзя сказать, что результат был полностью неожиданным, но он доказывает, что в органической химии действительно происходит новая революция. Химия выходит на следующий виток развития, который можно охарактеризовать словами "атомарная точность". Чтобы понять, как к такой точности пришли современные химики, надо отступить на несколько шагов назад.
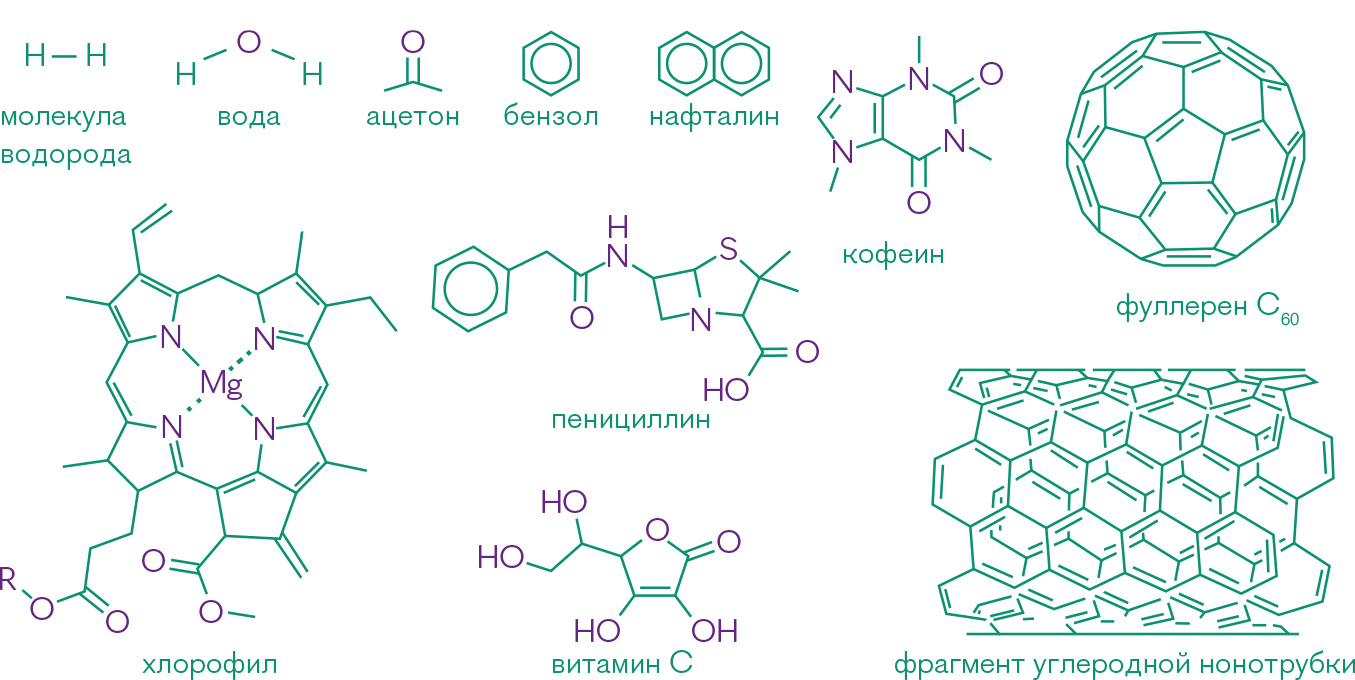
Рис 1. Водород, углерод, кислород
Уникальные химические свойства углерода—причина многообразия органических соединений и залог бесконечного практического потенциала тонкого органического синтеза (для сравнения приведены молекулы водорода и воды).
Квантовая химия: все ясно, только трудно подсчитать
До начала XX века химия напоминала книгу кулинарных рецептов — у кого-то получилось, вот и рецепт. Изменить ситуацию в одиночку химики не могли, потребовалось привлечение физических и физико-химических методов.
Стало понятно, что для объяснения и прогнозирования свойств молекул, а значит, их способности вступать в те или иные реакции, необходимо спуститься на уровень фундаментальных кирпичиков материи. Описанием же атомных ядер и электронов занимается уже не химия, а квантовая физика. Впоследствии часть квантовой физики, изучающая электронное строение молекул, выделилась в отдельную область — квантовую химию, которая стала мощнейшим инструментом для исследования механизмов химических реакций.
Фундаментальной основой квантовой химии является волновое уравнение, предложенное в 1926 году австрийским физиком Эрвином Шредингером. В применении к атомам и молекулам уравнение Шредингера описывает распределение электронов в поле ядер. Решая уравнение Шредингера для молекулы, можно определить области накопления электронов и области, обедненные электронами. И те и другие являются потенциальными реакционными центрами, по которым может протекать химическая реакция. Обладая такой информацией, химики могли целенаправленно планировать и получать продукты с заранее заданной структурой.
Зачем нужна зеленая химия
Изобилие новых органических материалов, большинство из которых не имеет природных аналогов, привело к значительному увеличению нагрузки на природные экосистемы. Это давление мы все ощущаем на себе. В последнее десятилетие в химическом сообществе, как среди ученых, так и среди промышленников, начала формироваться система взглядов, подходов и методов, которая получила название "зеленая химия". В рамках этой концепции перед химией поставлена сверхзадача по разработке "идеальных" синтетических процессов со 100-процентной селективностью, то есть приводящих к одному целевому продукту. Только в этом случае можно говорить о действительно экологически безопасных химических производствах, в которых не будет токсичных для природы отходов.
Спустя всего год после появления уравнения Шредингера, в 1927 году, Вальтер Гайтлер и Фриц Лондон выполнили успешный квантово-химический расчет молекулы водорода, которая содержит два протона и два электрона. Расчетные величины энергии связи молекулы и межъядерного расстояния совпали с экспериментальными данными. Квантовая теория молекул продемонстрировала свою работоспособность.
Продвинуться дальше молекулы водорода оказалось не так-то просто. Даже небольшое усложнение молекулы приводило к огромному математическому усложнению задачи. Как сказал в 1929 году Поль Дирак: "Основополагающие законы, необходимые для математического описания большей части физики и всей химии, полностью известны, трудность в том, что применение этих законов приводит к уравнениям, которые слишком сложны, чтобы их можно было решить".
Потребовались десятилетия и появление компьютерных технологий, чтобы квантово-химические расчеты небольших молекул (до 200 атомов) стали рутинной процедурой. В 1998 году "за разработку вычислительных методов квантовой химии" и "за развитие теории функционала плотности" были удостоены Нобелевской премии по химии Джон Попл и Вальтер Кон. А теория функционала электронной плотности (Density Functional Theory, DFT) является в настоящее время наиболее востребованным разделом квантовой химии и "рабочей лошадкой" большинства теоретических исследований.
75 миллионов разных молекул
По данным Химической реферативной службы (CAS — Chemical Abstracts Service) Американского химического общества, в 1990 году было зарегистрировано 10 миллионов соединений. В ноябре 2008 года зарегистрировано 40-миллионное соединение. В сентябре 2009 года — 50-миллионное. В мае 2011 года — 60-миллионное. В декабре 2012 года была достигнута отметка в 70 миллионов соединений. В ноябре 2013 года зарегистрирована 75-миллионная молекула. Такой быстрый прирост количества известных соединений обеспечен главным образом за счет органических молекул. Сейчас новое органическое соединение появляется каждые три секунды.
Регулировщики реакций — граничные орбитали
В работах японского химика-теоретика Кеничи Фукуи было показано, что для описания реакционной способности молекул наибольшее значение имеют не все молекулярные орбитали, а только так называемые граничные. В рамках теории граничных орбиталей реакция рассматривается как перераспределение электронов между занятой электронами граничной орбиталью одного реагента и свободной от электронов граничной молекулярной орбиталью другого реагента. Зная пространственную форму и энергию граничных молекулярных орбиталей, можно объяснять и прогнозировать реакционную способность молекул.
Обобщение экспериментального материала с учетом идей квантовой химии привело двух американских химиков Роалда Хоффмана и Роберта Вудворда к формулировке еще одной важной концепции, "Правила сохранения орбитальной симметрии". В соответствии с этим правилом, чтобы химическая реакция протекала легко, симметрии взаимодействующих молекулярных орбиталей реагентов должны определенным образом соответствовать друг другу.
Теория граничных орбиталей Фукуи и требования к симметрии орбиталей Вудворда-Хоффмана позволили объяснить многие закономерности в органической и элементоорганической химии.
Изучение механизмов реакций
При изучении химической реакции очень часто недостаточно знать геометрию и электронную структуру исходной молекулы-реагента. Необходимо изучить все состояния, через которые проходит реагирующая система на пути от исходных веществ к продуктам. Но промежуточные частицы в реакции могут существовать ничтожные отрезки времени, слишком короткие, чтобы зафиксировать и охарактеризовать их в опыте напрямую. Данные о механизмах таких реакций получают либо по косвенным экспериментальным признакам, либо методами квантово-химического моделирования. Другим направлением моделирования явлений на атомарном уровне является метод классической молекулярной динамики, позволяющий имитировать поведение систем из многих тысяч атомов. В 2013 году Мартин Карплус, Арье Уоршел и Майкл Левитт были удостоены Нобелевской премии по химии "за разработку многомасштабных моделей для сложных химических систем". В первую очередь под этим подразумевались методы классической молекулярной динамики.
Молекулярная динамика: чем проще, тем больше
Несмотря на огромные успехи квантовой химии в моделировании химических реакций с участием малых и средних молекул, ее возможности в моделировании больших молекулярных систем ограничены. Особенно это заметно при изучении биомолекул.
Например, даже небольшой полипептид инсулин состоит почти из 800 атомов. Но чтобы модель адекватно воспроизводила поведение биологических молекул, нужно "поместить" их в естественную среду, то есть окружить множеством молекул воды. А это еще в несколько раз увеличивает размер системы.
Кроме этого, надо выполнить моделирование динамики молекулы, движения ее атомов и групп с учетом движения окружающих молекул растворителя. Словом, увидеть "молекулярное кино". Например, как фермент связывается с молекулой субстрата, как сворачиваются в глобулы полипептидные цепочки или как движутся молекулы по каналу нанотрубки.
Даже на современных компьютерах удается провести квантово-химическое моделирование только относительно небольших структур. Для моделирования огромных молекулярных систем химики-теоретики пошли другим путем. Они вообще отказались от квантово-химического аппарата. Вид молекулы упрощают до точек-атомов с определенной массой, зарядом и направлением химических связей (как бы пружинок, соединяющих атомы).
Такой метод называется молекулярной механикой, а при моделировании динамических процессов (то есть для получения "молекулярного кино") — классической молекулярной динамикой (потому что он основан не на законах квантовой физики, а на законах физики классической).
Оказалось, что и с таким упрощенным подходом классическая молекулярная динамика дает хорошие результаты в биохимии, моделирование наноструктур также часто проводится именно этим методом. Даже для молекулярной системы из миллионов атомов классическая молекулярная динамика позволяет проследить траекторию движения каждого атома и его взаимодействие с другими атомами. А в конце 2013 года группе немецких ученых удалось осуществить молекулярно-динамическое моделирование системы из более чем четырех триллионов атомов.
Сейчас такие исследования проводятся с привлечением суперкомпьютеров. Но, учитывая темпы развития микропроцессорной техники, есть все основания предполагать, что в обозримом будущем такой масштаб моделируемых объектов станет доступным и на обычных рабочих станциях.
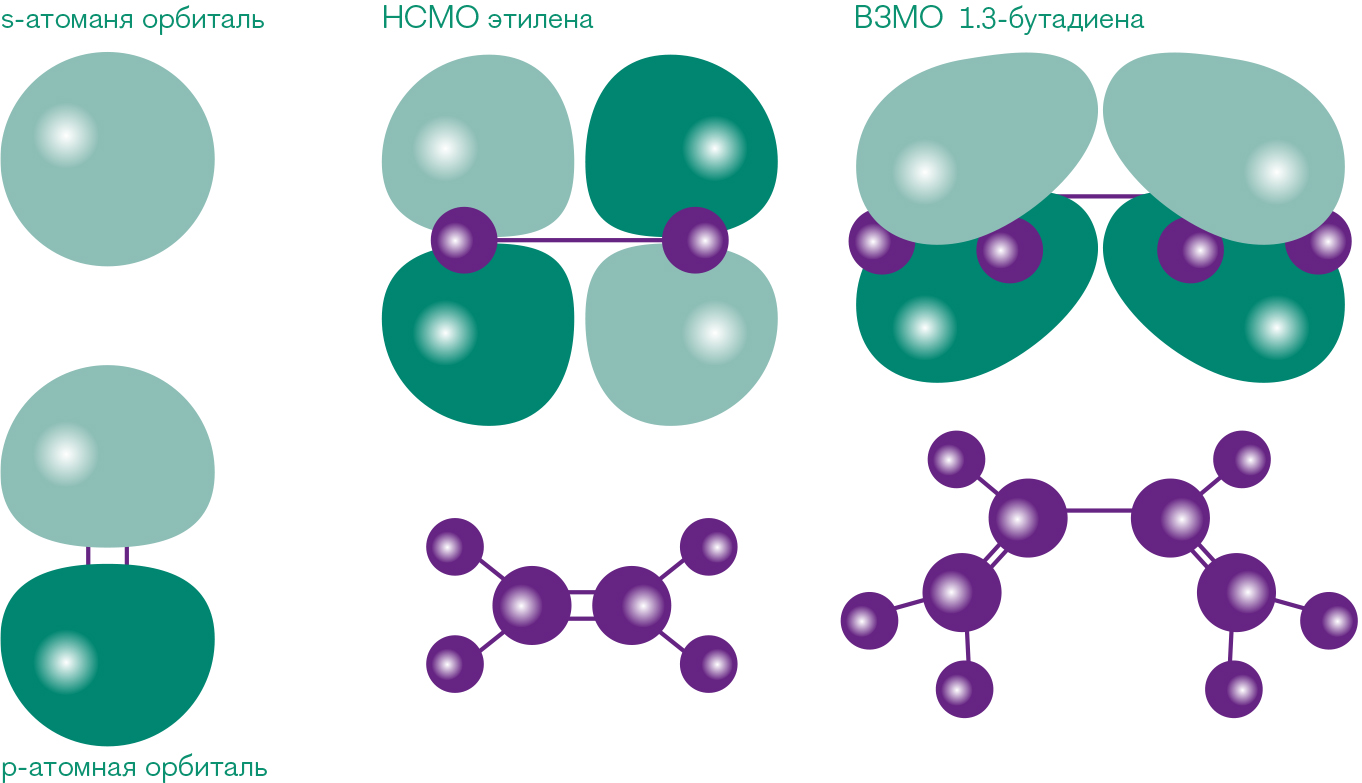
Рис. 2 s- и p-электронные обитали
Пространственные структуры s- и p-атомных орбиталей атома углерода и молекулярных орбиталей этилена и 1.3-бутадиена, взаимодействующих в ходе реакции циклоприсоединения. Дополнительно показано расположение молекул.
Лего для химиков
Чрезвычайно важное место при разработке эффективных синтетических методов занимают каталитические процессы. Особенно реакции образования связей углерод-углерод и углерод-гетероатом, с помощью которых получено большое количество фармацевтических препаратов и природных соединений.
Современные каталитические системы позволяют встраивать в органические молекулы целые блоки и собирать продукт как конструктор. Некоторые катализаторы реакции образования С-С связи (реакции циклоприсоединения и семейство реакций сочетания) на основе соединений палладия, никеля и меди позволяют осуществить реакцию по одному атому из десятков возможных. Здесь мы приходим к важнейшему параметру химических реакций — селективности, то есть способности реагировать с конкретным заданным атомом в молекуле, оставляя остальные атомы незатронутыми.
Реакции циклоприсоединения и сочетания позволяют создавать новые наноматериалы. Например, углеродные наноструктуры, такие как нанотрубки и графен, состоят из соединенных вместе непредельных углеродных циклов, которые могут вступать в реакцию циклоприсоединения. Следовательно, этот способ позволяет "прививать" различные функциональные группы на поверхность таких структур, существенно модифицируя их химические и физические свойства. И такие модификации в последнее время успешно осуществлены.
И сами углеродные наноматериалы, полициклические структуры, можно получить с помощью реакции циклоприсоединения. Если взять за основу один сегмент нанотрубки, то, присоединяя к нему молекулы непредельных углеводородов, можно формировать дополнительные сегменты, выращивая трубку, как полимер.
Главный синтез еще впереди
В аналитическом исследовании российских химиков, с которого началась эта статья, рассмотрены практически все современные селективные методы органического синтеза. Выделены ключевые направления, включая методы получения фторорганических соединений, каталитические реакции кросс-сочетания и окислительного кросс-сочетания, атом-экономные реакции присоединения, процессы метатезиса, реакции окисления и восстановления, получение гетероциклических соединений, создание новых гомогенных и гетерогенных каталитических систем, применение фотокатализа и другие.
Все это открывает практически безграничные возможности для синтеза новых веществ.