Поиск «неуловимых» каталитически активных частиц
Ученые из Института органической химии имени Н. Д. Зелинского РАН и ЮРГТУ (НПИ) исследовали механизмы реакций с участием комплексов палладия и платины и с наночастицами и кластерами этих металлов. Изученные реакции поставили под сомнение общепринятые представления о типах активных форм металла в каталитических реакциях. Работа опубликована в ACS Catalysis.
Катализ комплексами переходных металлов – один из ключевых подходов в получении биологически-активных соединений, иных продуктов тонкого органического синтеза, полимерных материалов и многих других веществ и материалов окружающего нас урбанистического мира. Катализатор – вещество, добавляемое в реакционную смесь и ускоряющее скорость химической реакции. За исследования в области катализа Нобелевским комитетом было присуждено десять премий, одна из которых в 2010 году была присвоена «За палладий-катализируемые реакции кросс-сочетания в органическом синтезе».
Бытует шуточное мнение, что сейчас практически любую химическую реакцию можно провести с помощью палладиевого катализатора. Это, конечно, не так, но в каждой шутке есть доля шутки. Соединения металлов платиновой группы, особенно палладия и платины, действительно активно применяются как катализаторы для огромного числа процессов: гидрирование/дегидрирования, образование связи углерод-углерод, углерод-гетероатом, гетероатом-гетероатом, реакций изомеризации и многих других, – как в лабораторной практике, так и промышленности. В крупнотоннажной промышленности обычно предпочитают использовать гетерогенный катализ – активные формы металла, нанесенные на инертный носитель, это обычно позволяет использовать ценный материал многократно. В тонком органическом синтезе гомогенный катализ имеет не меньшее значение, так как детально разработанные комплексы металлов позволяют получать молекулы недоступные для синтеза другими методами.
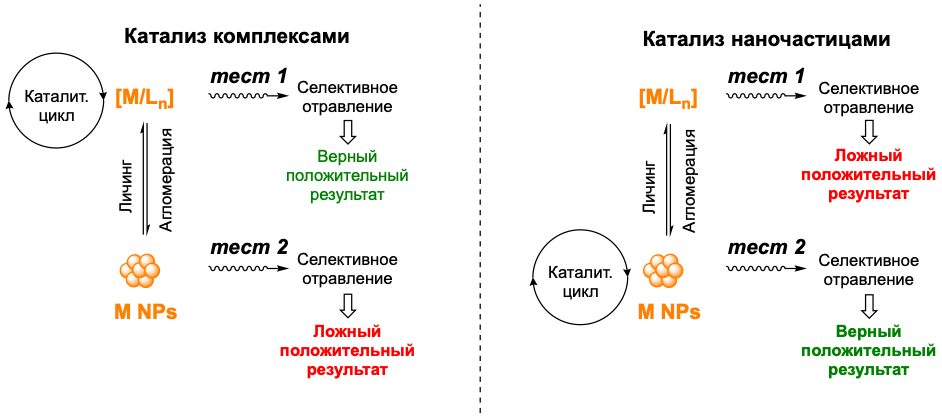
При исследовании любой каталитической системы важно понять, как ведет себя катализатор, как он эволюционирует, и какая из форм используемого соединения металла является наиболее активной. В подобных системах возможны процессы кластеризации и роста наночастиц из монометаллических комплексов, а также обратный процессы вымывания, известные в литературе как «личинг» – превращение гетерогенных форм в гомогенные. Неверное понимание механизма используемой реакции может привести не только к потере активности, но и загрязнению целевых продуктов реакции соединениями тяжелых металлов, что потребует дополнительной дорогостоящей очистки. Для идентификации активных форм были разработаны различные тесты на гомогенность или гетерогенность каталитической реакции. Одним из наиболее универсальных и распространённых являлся так называемый «ртутный тест». Его суть заключается в добавлении капли ртути в реакционную смесь и если реакция останавливается, то имеет место гетерогенный катализ, а если продолжает идти, то – гомогенный.
В своем исследовании авторы на примере наиболее распространенных гомогенных и гетерогенных катализаторов на основе палладия и платины продемонстрировали, что, к сожалению, этот тест дает ложные результаты и должен быть исключен из арсенала химиков. Ртуть не только может очень быстро реагировать с молекулярными гомогенными катализаторами останавливая реакцию, но и медленно реагировать в гетерогенными катализаторами на подложке.
Рисунок 1. Фундаментальная проблема концепции селективных катализаторов для определения механизма реакции.
Другая важная проблема, поднимаемая авторами – надежность самого принципа «селективных» тестов в катализе. Любая каталитическая система эволюционирует во времени, а значит взаимопревращения между гомогенными и гетерогенными формами катализатора будут всегда присутствовать. По этой причине любой селективный тест будет выводить из системы одну форму, что мгновенно будет провоцировать ее образование за счет химического равновесия и это фундаментальное ограничение требует дополнительных исследований.
Фото в начале статьи: Palladium nanocubes. Credit:Berkeley Lab
Источник: Mendeleev.info